1. シナプス形成と可塑性の分子機構
シナプス形成と可塑性の制御機構について、小脳または海馬神経細胞の培養系および脳切片標本を用いた研究を行っています。実験方法としては、電気生理学・蛍光ライブイメージングと分子生物学を組み合わせています。一部の研究では、コンピューターシミュレーションも活用しています。これまでは、小脳プルキンエ細胞上の興奮性および抑制性シナプスで起こる可塑性に関する研究が中心でしたが、2012年には海馬培養神経細胞を用いて後述するような新実験手法を確立し、長期増強時のグルタミン酸受容体動態に関する新知見を発表しました。 小脳皮質では、唯一の出力細胞であるプルキンエ細胞で、興奮性シナプス入力の長期抑圧と抑制性シナプス入力の脱分極依存性増強等のシナプス可塑性が起り、それらは運動学習の基盤と考えられています(下図参照)。私たちは、これら2種類のシナプス可塑性の発現・維持・制御の分子機構解明に向けた研究を行ってきました。
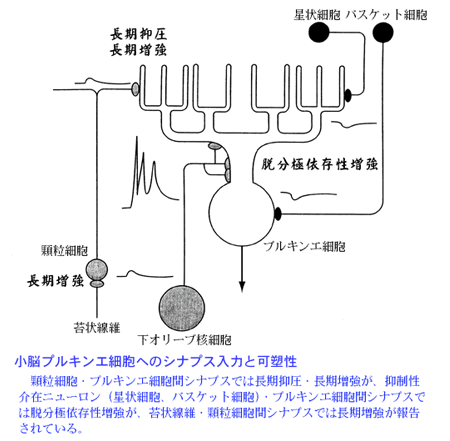
シナプス形成と可塑性の制御機構について、小脳または海馬神経細胞の培養系および脳切片標本を用いた研究を行っています。実験方法としては、電気生理学・蛍光ライブイ・E=[ジングと分子生物学を組み合わせています。一部の研究では、コンピューターシミュレーションも活用しています。これまでは、小脳プルキンエ細胞上の興奮性および抑制性シナプスで起こる可塑性に関する研究が中心でしたが、2012年には海馬培養神経細胞を用いて後述するような新実験手法を確立し、長期増強時のグルタミン酸受容体動態に関する新知見を発表しました。 小脳皮質では、唯一の出力細胞であるプルキンエ細胞で、興奮性シナプス入力の長期抑圧と抑制性シナプス入力の脱分極依存性増強等のシナプス可塑性が起り、それらは運動学習の基盤と考えられています(下図参照)。私たちは、これら2種類のシナプス可塑性の発現・維持・制御の分子機構解明に向けた研究を行ってきました。 興奮性シナプス伝達の長期抑圧は、顆粒細胞・プルキンエ細胞間シナプスで起こる可塑性で、プルキンエ細胞への顆粒細胞からのシナプス入力と下オリーブ核からのシナプス入力が同期した時に引き起こされます。私たちは、この可塑性が培養系で起こることを示してその時間経過を明らかにしました(Hirano 1990, Murashima & Hirano 1999)。また、長期抑圧発現にグルタミン酸受容体デルタ2サブユニット・メタボトロピックグルタミン酸受容体mGluR1・MAPキナーゼ・カルシニューリン等がかかわること報告し(Hirano et al 1994, Shigemoto et al 1994, Kashiwabuchi et al 1995, Kawasaki et al 1999, Fujii & Hirano 2002)、グルタミン酸受容体デルタ2サブユニットとPICK1の結合が長期抑圧発現にかかわることを明らかにしました(Yawata et al 2006)。さらに、グルタミン酸受容体デルタ2サブユニットと細胞内で結合する分子として同定されたデルフィリンを欠損したマウスで、長期抑圧が起こりやすくなることも発見しました(Takeuchi et al 2008)。なお、このデルフィリン欠損マウスでは一部の運動学習の促進が認められました(プレス発表資料1参照)。
抑制性介在ニューロンである星状細胞とプルキンエ細胞間の抑制性シナプスでは、プルキンエ細胞が脱分極するとシナプス伝達が増強される脱分極依存性増強が起こります。この可塑性について私たちは、シナプス活動がGABA(B)受容体を介してシナプス可塑性の発現を抑えるというユニークなシナプス可塑性制御機構を発見しました(Kawaguchi & Hirano 2000)。そしてその分子機構の解析を行い、GABA(B)受容体がGi/o蛋白質・cAMP・アデニリールシクラーゼ・PKA・DARPP32を介してカルモジュリン依存性キナーゼに拮抗するプロテインフォスファターゼ活性を制御することにより、可塑性発現が抑えられることを明らかにしました(Kawaguchi & Hirano 2002)。さらに、脱分極依存性増強を制御する細胞内情報伝達系の理論モデルを構築して、コンピューターシミュレーションによる解析も実施しました。そして、カルモジュリン依存性キナーゼにより活性制御されるフォスフォジエステラーゼPDE1が、脱分極依存性増強の起こりやすさに大きな影響を及ぼす等の理論予測を得て、それを生理学実験で実証しました(Kitagawa et al, 2009; Kawaguchi et al, 2011)。また、GABA受容体結合タンパク質として知られているGABARAP分子のカルモジュリン依存性キナーゼ活性に依存したコンフォーメーション変化が脱分極依存性増強にかかわることも明らかにしました(Kawaguchi & Hirano 2007)。 シナプス形成に関しましては、上述しましたグルタミン酸受容体デルタ2サブユニットが細胞外領域を介して、顆粒細胞のシナプス前終末の分化を引き起こす作用を有し、シナプス形成にかかわること等を明らかにしました(Kuroyanagi et al 2009, 2010, Ryu et al., 2011)。これらの結果は、シナプスにおける情報伝達に専従していると考えられてきた伝達物質受容体の関連分子が、シナプス形成に直接関与していることを示すものとなりました(プレス発表資料2参照)。
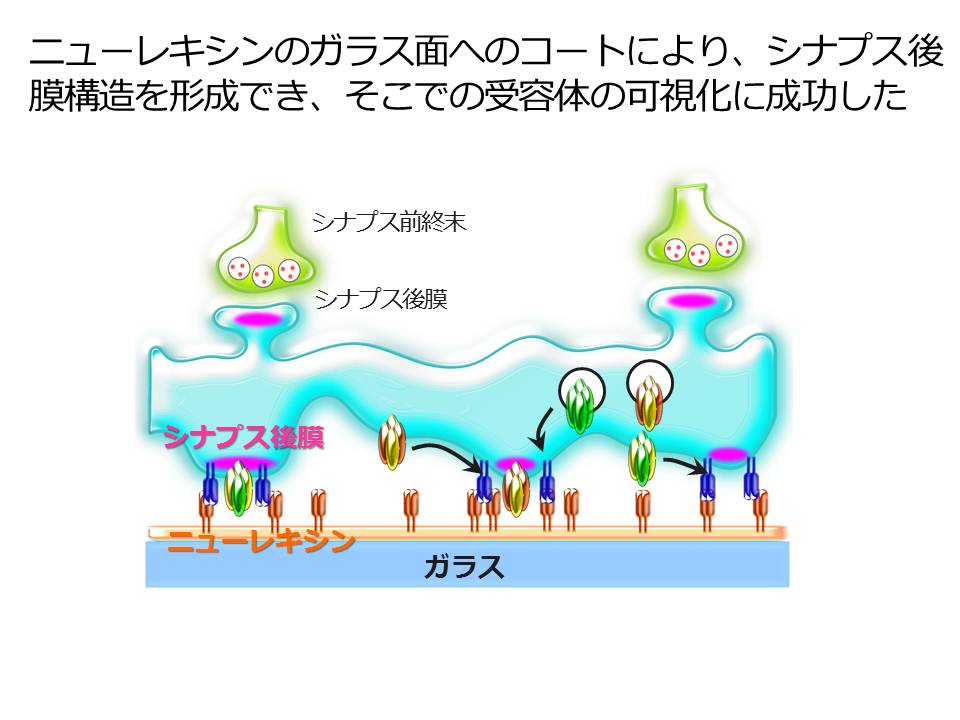
最近の興味深い成果としましては、海馬の長期増強発現に際してグルタミン酸受容体がいかなる挙動をするかを可視化するために、新実験手法を確立して、異なるサブタイプのAMPA型グルタミン酸受容体が異なる経路とタイミングでシナプス後膜に集積することを示した研究があります(Tanaka & Hirano, 2012)。この研究では、シナプス形成にかかわるニューレキシンでガラス面をコートして、その上で海馬神経細胞を培養しました。神経細胞には蛍光タンパク質Sepを融合したAMPA型グルタミン酸受容体サブユニット(GluA1, GluA2またはGluA3)を発現させ、Sepが発する蛍光を高いシグナル・ノイズ比が得られる全反射蛍光顕微鏡で観察しました。この方法によって、長期増強発現に際して、各AMPA受容体サブユニットがシナプス後膜内外でどのように増減するかと、各AMPA受容体が異なるタイミングでまた別の経路を通りシナプス後膜へ集積することを明らかにできました(プレス発表資料3参照)。